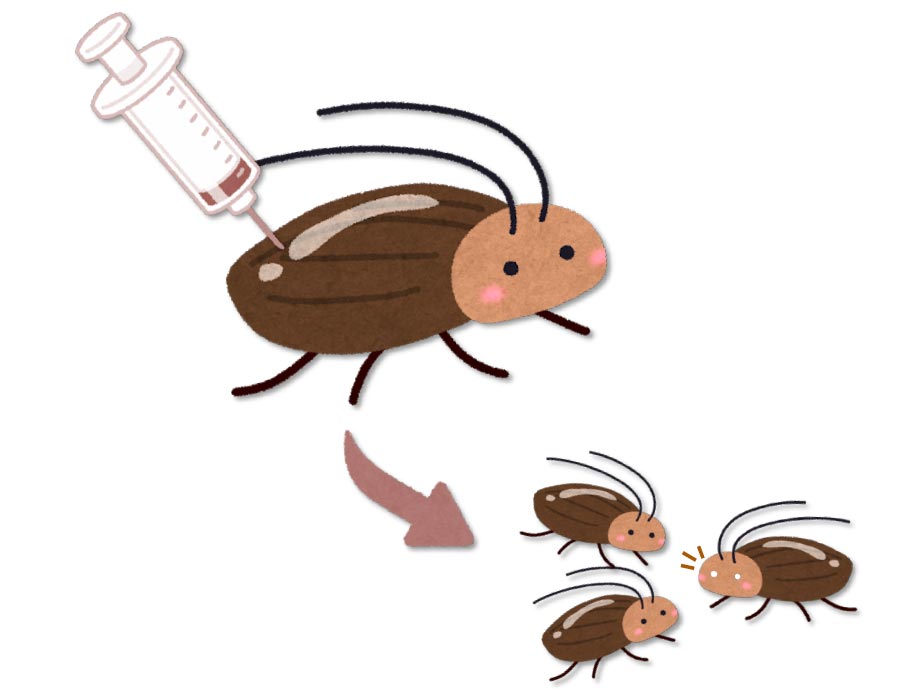
Laut einer in der Zeitschrift veröffentlichten Forschungsarbeit Zellberichtsmethoden Von Cell Press am 16. MaijIm Jahr 2022 entwickelten Forscher die CRISPR-Cas9-Technologie, um die Genbearbeitung bei Kakerlaken zu ermöglichen. Das direkte und wirksame CRISPR-Verfahren (DIPA-CRISPR) beinhaltet die Injektion von Substanzen in erwachsene Frauen, in denen die Eier und nicht die Embryonen selbst wachsen.
„In gewisser Weise wurden die Insektenforscher von der Unbequemlichkeit befreit, die Eier zu injizieren“, sagt der leitende Studienautor Takaaki Daimon von der Universität Kyoto. Wir können jetzt Insektengenome freier und aus eigenem Antrieb modifizieren. Im Prinzip sollte diese Methode bei mehr als 90 % der Insektenarten funktionieren.“
„Indem wir die DIPA-CRISPR-Methode verbessern und effizienter und vielseitiger machen, können wir möglicherweise die Genom-Editierung in fast allen der mehr als 1,5 Millionen Insektenarten ermöglichen und uns eine Zukunft eröffnen, in der wir die Vorteile voll ausschöpfen können erstaunliche biologische Funktionen von Insekten.“ – Takaaki Damon
Gegenwärtige Gen-Editierungsmethoden von Insekten erfordern typischerweise eine Mikroinjektion von Material in frühe Embryonen, was ihre Anwendung auf viele Arten stark einschränkt. Beispielsweise haben frühere Studien die genetische Manipulation von Kakerlaken aufgrund ihres einzigartigen Fortpflanzungssystems nicht untersucht. Darüber hinaus erfordert die Bearbeitung von Insektengenen oft teure Ausrüstung, einen spezifischen Versuchsaufbau für jede Art und hochqualifiziertes Laborpersonal. „Diese Probleme mit herkömmlichen Methoden haben Forscher geplagt, die Genom-Editing an einer Vielzahl von Insektenarten durchführen wollen“, sagt Damon.
Um diese Einschränkungen zu überwinden, injizierten Damon und seine Mitarbeiter Cas9-Ribonukleoproteine (RNPs) in die Hauptkörperhöhle erwachsener weiblicher Grillen, um genetische Mutationen in sich entwickelnde Eizellen einzuführen. Die Ergebnisse zeigten, dass die Gen-Editing-Effizienz – der Anteil der modifizierten Individuen an der Gesamtzahl der geschlüpften Individuen – bis zu 22 % betragen könnte. Beim Mehlkäfer erzielte DIPA-CRISPR eine Effizienz von über 50 %. Darüber hinaus stellten die Forscher tödliche genetische Käfer her, indem sie einzelsträngige Oligonukleotide und Cas9-RNPs gleichzeitig injizierten, aber die Effizienz ist gering und sollte weiter verbessert werden.
Die erfolgreiche Anwendung von DIPA-CRISPR bei zwei evolutionär entfernten Arten zeigt seine weit verbreitete Verwendung. Dieser Ansatz ist jedoch nicht direkt auf alle Arten von Insekten anwendbar, einschließlich Fruchtfliegen. Darüber hinaus haben Experimente gezeigt, dass der wichtigste Faktor für den Erfolg das Injektionsstadium bei erwachsenen Frauen ist. Folglich erfordert DIPA-CRISPR eine gute Kenntnis der Eierstockentwicklung. Dies kann bei einigen Arten aufgrund der unterschiedlichen Lebensgeschichte und Fortpflanzungsstrategien von Insekten eine Herausforderung darstellen.
Trotz dieser Einschränkungen ist DIPA-CRISPR zugänglich, sehr praktisch und leicht in Labors zu implementieren, wodurch die Anwendung der Genbearbeitung auf eine Vielzahl von Modell- und Nicht-Modell-Insektenarten erweitert wird. Diese Technologie erfordert minimale Ausrüstung, um Erwachsenen zu injizieren, und nur zwei Komponenten – Cas9-Protein und eine einzige Anleitung[{“ attribute=““>RNA—greatly simplifying procedures for gene editing. Moreover, commercially available, standard Cas9 can be used for adult injection, eliminating the need for time-consuming custom engineering of the protein.
“By improving the DIPA-CRISPR method and making it even more efficient and versatile, we may be able to enable genome editing in almost all of the more than 1.5 million species of insects, opening up a future in which we can fully utilize the amazing biological functions of insects,” Daimon says. “In principle, it may be also possible that other arthropods could be genome edited using a similar approach. These include agricultural and medical pests such as mites and ticks, and important fishery resources such as shrimp and crabs.”
Reference: “DIPA-CRISPR is a simple and accessible method for insect gene editing” by Yu Shirai, Maria-Dolors Piulachs, Xavier Belles and Takaaki Daimon, 16 May 2022, Cell Reports Methods.
DOI: 10.1016/j.crmeth.2022.100215
This work was supported by funding from JSPS KAKENHI, JSPS Open Partnership Joint Research Projects, Spanish Ministry of Innovation and Competitiveness, and CSIC-Spain, and in part by Cabinet Office, Government of Japan, Cross-ministerial Moonshot Agriculture, Forestry and Fisheries Research and Development Program.

„Entdecker. Entschuldigungsloser Unternehmer. Alkoholfanatiker. Zertifizierter Schriftsteller. Möchtegern-TV-Evangelist. Twitter-Fanatiker. Student. Webwissenschaftler.





More Stories
Die NASA macht in Bezug auf die Erde eine Entdeckung, die „so wichtig wie die Schwerkraft“ ist
Wie wurden Schwarze Löcher so groß und schnell? Die Antwort liegt im Dunkeln
Eine Studentin der University of North Carolina wird die jüngste Frau sein, die an Bord von Blue Origin die Grenzen des Weltraums überschreitet